Come i cowboy: un lazo per antibiotico
Giovanni Pellegrino
MD, Università degli Studi di Bari “Aldo Moro”
e-mail: g.pellegrino21@alumni.uniba.it
Indice
1. Superbatteri, superproblema
2. Non si deve scappare solo dai batteri: ecco gli altri supermicrobi!
3. Ecco una supersoluzione: la scoperta della lariocidina
4. Focus: cosa sono i peptidi lazo
Abstract. Antimicrobial resistance (AMR) is one of the most important challenges in the world, with bacteria evolving faster than new drugs. The discovery of lariocidin, an antibiotic derived from Paenibacillus, offers new hope against resistant bacteria. Lasso peptides, including lariocidin, are a promising therapeutic solution due to their stability and antimicrobial activity.
Keywords: antimicrobicoresistenza; lariocidina; peptidi lazo
1. Superbatteri, superproblema

L’antibiotico che prendi per il mal di gola ha i giorni contati. No, non è l’inizio di una serie TV distopica, ma una delle sfide più toste del nostro secolo: l’antimicrobicoresistenza (AMR). Gli antibiotici, quegli eroici composti che ci hanno salvato da infezioni potenzialmente mortali nell’ultimo secolo, stanno perdendo efficacia perché i batteri, con la pazienza di uno studente di chimica organica e l’astuzia di un hacker, si stanno evolvendo.
Secondo l’Organizzazione Mondiale della Sanità (OMS), ogni anno l’AMR è responsabile di oltre 1,2 milioni morti; si stima, addirittura, che le infezioni da germi AMR diventeranno una delle prime cause di morte entro il 2050, se non si dovesse intervenire con misure significative [1]. Purtroppo, l’Italia è uno dei Paesi con il più alto tasso di AMR in Europa (Figura 1) e, sul territorio nazionale, le zone geografiche meno virtuose sono la Lombardia e il Centro-Sud (Figura 2).
Quindi sì, Houston abbiamo un problema… e il problema è che non abbiamo nuovi antibiotici.
Negli ultimi decenni, ahinoi, lo sviluppo di nuovi antibiotici ha subito un rallentamento significativo. Le ragioni sono molteplici: costi elevati di ricerca e sviluppo, tempi estremamente lunghi per l’approvazione e un ritorno economico spesso insufficiente, tale da non coprire le spese sostenute. Ciò ha portato a una situazione in cui i batteri si evolvono e diventano resistenti più rapidamente di quanto si riesca a sviluppare nuovi farmaci efficaci [1].
Alcuni batteri sono così ostinati e pericolosi da meritarsi un acronimo tutto loro: ESKAPE [2]. I medici lo usano anche in chiave scherzosa – perché da questi patogeni “bisognerebbe proprio scappare”! L’acronimo raccoglie i principali batteri super-resistenti che mettono in crisi gli ospedali di tutto il mondo:
- Enterococcus faecium ed Enterococcus fecalis
- Staphylococcus aureus
- Klebsiella pneumoniae
- Acinetobacter baumanii
- Pseudomonas aeruginosa
- Enterobacter spp., oppure Escherichia coli
Questi microrganismi hanno sviluppato nel tempo meccanismi sofisticati per eludere l’azione degli antibiotici, rendendo molte infezioni difficili o addirittura impossibili da trattare con i farmaci fino ad ora disponibili.
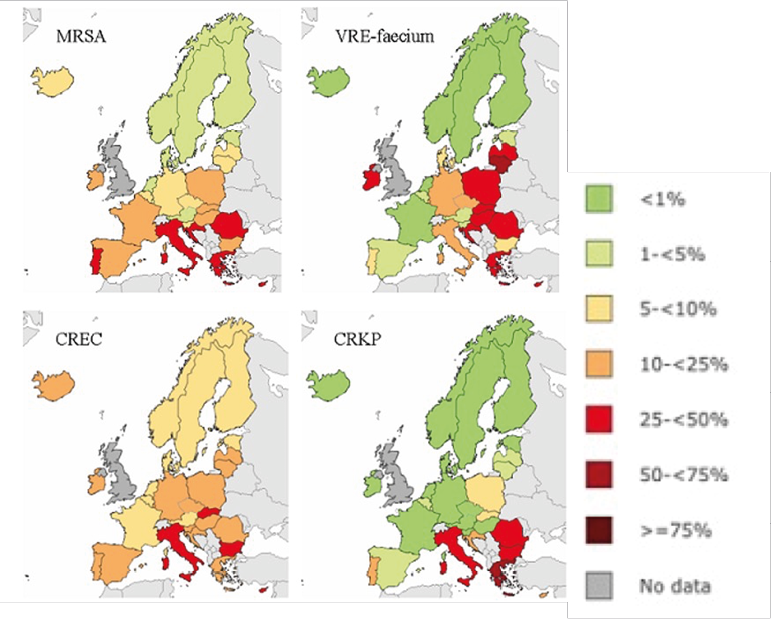
Figura 1. Percentuale dei ceppi resistenti agli antibiotici rispetto ai ceppi isolati, resistenti e sensibili agli antibiotici, nell’Unione Europea durante l’anno 2020; si noti che l’Italia è spesso fanalino di coda, cioè è uno dei Paesi europei con la più alta percentuale di ceppi resistenti (MRSA: Staphylococcus aureus resistente alla meticillina; VRE-faecium: Enterococcus faecium resistente alla vancomicina; CREC: Escherichia coli resistente alle cefalosporine di III generazione, CRKP: Klebsiella pneumoniae resistente ai carbapenemi)
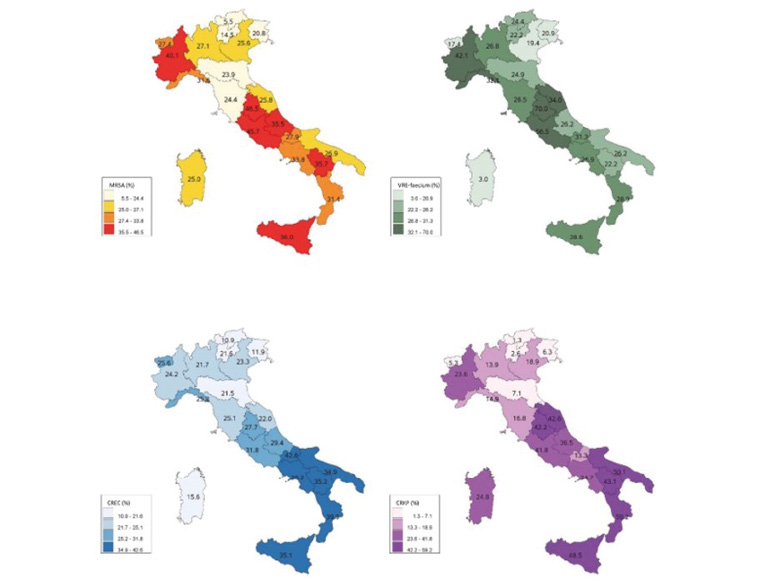
Figura 2. Percentuale dei ceppi resistenti agli antibiotici rispetto ai ceppi isolati, resistenti e sensibili agli antibiotici, in Italia durante l’anno 2022; le zone geografiche più virtuose sono l’Emilia-Romagna, il Triveneto e la Sardegna; le meno virtuose sono la Lombardia e il Centro-Sud (MRSA: Staphylococcus aureus resistente alla meticillina; VRE-faecium: Enterococcus faecium resistente alla vancomicina; CREC: Escherichia coli resistente alle cefalosporine di III generazione, CRKP: Klebsiella pneumoniae resistente ai carbapenemi)
2. Non si deve scappare solo dai batteri: ecco gli altri supermicrobi!
Gli ESKAPE non sono gli unici “cattivi” della storia [2]. La tubercolosi, ad esempio, è tutt’altro che una malattia del passato. Causata da Mycobacterium tuberculosis, si sta rivelando sempre più resistente ai principali farmaci come la rifampicina e l’isoniazide, complicando le strategie terapeutiche e minacciando anche i Paesi che pensavano di averla debellata.
A preoccupare non sono solo i batteri. Ci sono anche dei “superfunghi” – miceti resistenti agli antimicotici – che possono causare infezioni sistemiche molto gravi, soprattutto in pazienti immunodepressi. Candida auris e Aspergillus fumigatus, ad esempio, sono nomi sempre più familiari ai reparti di terapia intensiva.
Non va meglio con certi parassiti, come quelli del genere Plasmodium, responsabili della malaria. In molte aree tropicali, queste forme di malaria non rispondono più al chinino, un tempo baluardo terapeutico, costringendo i medici a ricorrere a farmaci più potenti e talvolta più tossici, come l’artemisina e l’artesunato.
Infine, non possiamo dimenticare le cosiddette “malattie tropicali neglette”: patologie diffuse nelle aree più povere del pianeta, spesso ignorate dalla ricerca farmaceutica perché considerate “poco redditizie”. La carenza di terapie efficaci, aggravata dalla comparsa di resistenze, rende la gestione di queste malattie un problema sanitario di portata globale. Esempi sono la lebbra, la malattia del sonno, la noma o l’ulcera del Buruli.
In questo panorama, la lotta contro l’AMR non è solo una sfida tecnologica, ma anche etica: occorrono nuovi farmaci, nuove idee e un impegno condiviso, affinché nessuno venga lasciato indietro.
3. Ecco una supersoluzione: la scoperta della lariocidina
In questa crisi globale, una recente scoperta offre nuove speranze nel trattamento delle infezioni batteriche. Un gruppo di ricercatori canadesi, guidati dal prof. Gerry Wright della McMaster University, ha identificato un nuovo antibiotico chiamato lariocidina [3]. La molecola è stata isolata da un batterio del suolo del genere Paenibacillus (Figura 3), raccolto nel giardino di un tecnico di laboratorio. Dopo un anno di coltivazione in vitro, i ricercatori hanno scoperto che questo batterio produceva una sostanza dalle forti proprietà antimicrobiche [4].

Figura 3. Colonie di Paenibacillus [5]: quando i germi vengono analizzati, si dice che vengono messi in coltura, cioè il campione viene in una miscela che contiene diversi fattori nutrienti detta terreno in modo che il germe possa proliferare e dare delle piccole macchioline rotondeggianti dette colonie (la conta microbica, ovvero il numero di germi presenti nel campione originale, si definisce in unità formanti colonie); i Paenibacillus sono unici nel loro genere perché formano colonie a spirali, vorticose, quasi artistiche
La lariocidina è un peptide antimicrobico appartenente alla classe dei “peptidi lazo” [4]. Questi peptidi sono caratterizzati da una struttura unica: un anello di amminoacidi attraverso il quale passa una “coda” lineare, conferendo alla molecola una forma simile a un lazo (Figura 4). Questa conformazione conferisce stabilità termica e resistenza alla degradazione enzimatica, rendendo la lariocidina particolarmente efficace come agente antibiotico.

Figura 4. Struttura schematica di un lazo
La lariocidina agisce in modo diverso rispetto agli antibiotici tradizionali (Figura 5) [6]. Si lega a un sito specifico del ribosoma batterico, interferendo con la sintesi proteica, essenziale per la sopravvivenza del batterio. In particolare, interagisce con l’RNA ribosomiale 16S e l’aminoacil-tRNA, inibendo la traslocazione e inducendo errori nella codifica delle proteine. Questo meccanismo unico la rende efficace contro batteri resistenti ad altri antibiotici.
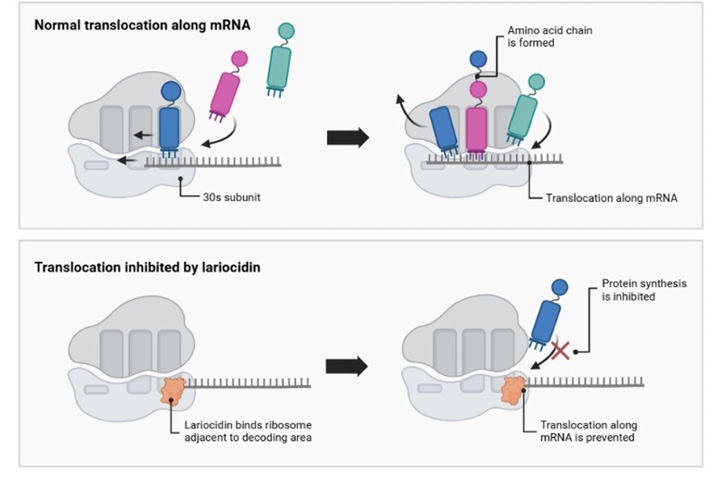
Figura 5. Meccanismo d’azione della lariocidina [6]
Nei test preclinici, la lariocidina ha dimostrato un’ampia efficacia contro batteri Gram-positivi e Gram-negativi, inclusi ceppi resistenti come Acinetobacter baumannii. Inoltre, non ha mostrato tossicità significativa per le cellule umane, suggerendo un buon profilo di sicurezza. Queste caratteristiche la rendono una candidata promettente per lo sviluppo di nuovi farmaci antibiotici.
La scoperta della lariocidina rappresenta un passo significativo nella lotta contro l’AMR. Tuttavia, il percorso verso l’uso clinico è ancora lungo. Saranno necessari ulteriori studi per confermare l’efficacia e la sicurezza della molecola nell’uomo, oltre a sviluppare metodi di produzione su larga scala. Se questi ostacoli saranno superati, la lariocidina potrebbe inaugurare una nuova era nella terapia antibiotica.
4. Focus: cosa sono i peptidi lazo
I peptidi lazo (o lasso peptides) sono una famiglia relativamente recente e ancora poco esplorata di peptidi prodotti da batteri, che si distinguono per una struttura davvero insolita. Vengono sintetizzati in modo convenzionale dai ribosomi – come la maggior parte delle proteine – ma poi subiscono modificazioni chimiche post-traduzionali da parte di specifici enzimi batterici. Ed è proprio in queste modifiche che sta il segreto della loro straordinaria stabilità e attività biologica [7].
Ma cosa li rende così speciali? La loro architettura unica: i peptidi lazo sono formati da 15 a 24 amminoacidi e hanno una conformazione tridimensionale particolare, simile a un lazo, appunto. La molecola si compone di un anello macrolattamico all’estremità N-terminale (cioè nella parte iniziale del peptide), che intrappola una coda C-terminale al suo interno. È come se la coda passasse dentro l’anello e venisse bloccata lì in modo permanente, creando una struttura a “nodo” molto compatta e resistente.
A garantire questo intrappolamento ci pensano due elementi: amminoacidi voluminosi (come Phe, Tyr o Trp), posizionati strategicamente sopra e sotto l’anello e, in alcune classi, ponti disolfuro che fanno da “fermo meccanico” collegando l’anello alla coda.
I peptidi lazo noti vengono suddivisi in tre classi principali, in base alla presenza di ponti disolfuro (Figura 6) [8]:
- Classe I: contengono due ponti disolfuro.
- Classe II: nessun ponte disolfuro (ma si affidano ad amminoacidi ingombranti per mantenere la struttura).
- Classe III: contengono un solo ponte disolfuro.
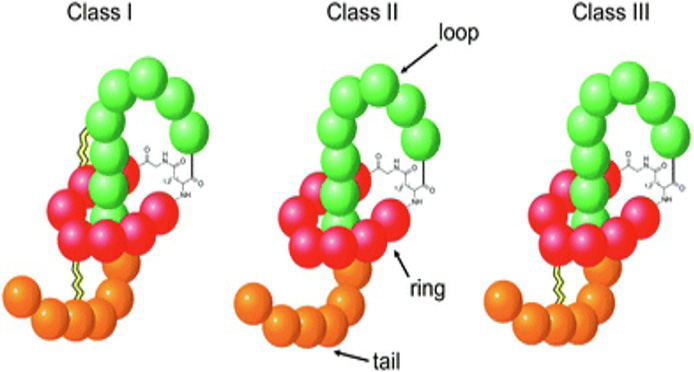
Figura 6. Classificazione dei peptidi lazo [8]
Questa struttura a nodo non è solo curiosa dal punto di vista chimico: è anche estremamente stabile, sia nei confronti delle proteasi (gli enzimi che normalmente “tagliano” le proteine), sia rispetto a condizioni ambientali difficili, come alte temperature o pH estremi.
A cosa servono [8]? Questi peptidi non si limitano a essere piccoli capolavori strutturali. Hanno infatti numerose attività biologiche molto interessanti:
- possono inibire alcuni enzimi;
- possono legare certi recettori cellulari, inibendone l’attività;
- possono fungere da antibiotici e antivirali, inclusa un’attività documentata contro l’HIV.
Queste caratteristiche li rendono promettenti candidati terapeutici: piccole molecole naturali, stabili, attive e con la possibilità di essere ingegnerizzate per bersagli specifici.
La biosintesi dei peptidi lazo è una vera opera di ingegneria molecolare naturale (Figura 7). Tutto parte da un precursore peptidico lineare detto LasA, che contiene una porzione “leader” (una sorta di etichetta) e una porzione “core”, cioè il futuro peptide attivo. Una volta prodotto, LasA viene processato da un complesso enzimatico specializzato – chiamato lazo-sintetasi – composto principalmente da una proteasi, che rimuove la parte leader, e una sintetasi propriamente detta, che chiude l’anello attraverso una ciclizzazione chimica
Il risultato è una struttura che finora si è dimostrata difficile da ottenere con la sintesi chimica tradizionale, ma che la natura realizza con elegante precisione.
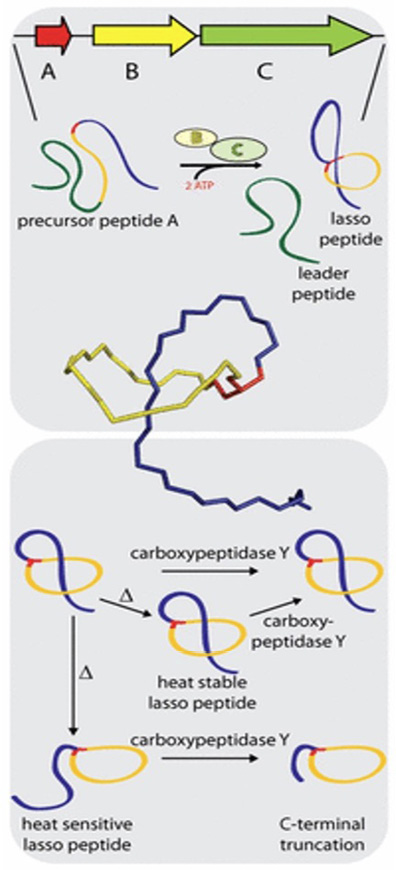
Figura 7. Un peptide lazo è in genere prodotto come un lungo precursore peptidico (A) il quale, in presenza di alcuni cofattori (B e C, nonché due molecole di ATP per ogni molecola di peptide), si degrada a dare il peptide lazo e un peptide leader, di scarto; la conformazione da peptide lazo fa sì che la lariocidina sia termoresistente e resistente all’azione degli enzimi responsabili dell’antimicrobico-resistenza, come la carbossipeptidasi; uno shock termico significativo può cambiare la conformazione del peptide lazo con la coda che non è più contenuta propriamente nel lazo [7]
Oltre alla lariocidina, un altro peptide lazo molto conosciuto è la microcina J25; ad oggi sono stati identificati alcune decine di peptidi lazo, distribuiti in diversi batteri, soprattutto tra Actinobacteria e Proteobacteria [8].
La loro distribuzione suggerisce che molti altri potrebbero essere ancora nascosti in ambienti naturali poco esplorati. Ed è proprio lì, tra suoli, sedimenti e microrganismi “silenziosi”, che potrebbero celarsi i farmaci del futuro!
[1] World Health Organization, Antimicrobial resistance, Geneva, WHO, 2024 [cited 2025, Jun 4]. Available from: https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance
[2] E. Tacconelli, E. Carrara, A. Savoldi, et al., Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis, Lancet Infect Dis., 2018, 18(3), 318-327 [doi: 10.1016/S1473-3099(17)30753-3; https://pubmed.ncbi.nlm.nih.gov/29276051/].
[3] K. A. Muñoz, R. J. Ulrich, A.K. Vasan, et al., A Gram-negative-selective antibiotic that spares the gut microbiome, Nature, 2024, 630, 429-436 [https://www.nature.com/articles/s41586-024-07502-0].
[4] M. Jangra, D. Y. Travin, E. V. Aleksandrova, et al., A broad-spectrum lasso peptide antibiotic targeting the bacterial ribosome, Nature, 2025, 640, 1022-1030 [https://doi.org/10.1038/s41586-025-08723-7].
[5] By Prof. E. Ben-Jacob, CC BY-SA 3.0 [https://commons.wikimedia.org/w/index.php?curid=22947528].
[6] P. G. Arnison, M. J. Bibb, G. Bierbaum, et al., Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature, Nat. Prod. Rep., 2013, 30(1), 108-160 [doi: 10.1039/c2np20085f; PMID 23165928; PMCID PMC3954855].
[7] J. D. Hegemann, M. Zimmermann, X. Xie, M. A. Marahiel, Lasso peptides: an intriguing class of bacterial natural products, Acc. Chem. Res., 2015, 48(9), 1909-1919.
[8] M. O. Maksimov, S. J. Pan, A. J. Link, Lasso peptides: structure, function, biosynthesis, and engineering, Nat. Prod. Rep., 2012, 29(9), 996-1006 [doi: 10.1039/c2np20070h].