L’isomerizzazione fotochimica del carvone, la prima reazione fotochimica stereospecifica
Maurizio D’Auria e Rocco Racioppi
Dipartimento di Scienze di Base ed Applicate, Università della Basilicata
e-mail: maurizio.dauria53@gmail.com
Abstract. Ciamician in 1908 described the first stereospecific photochemical reaction irradiating a natural occurring chiral terpene, carvone. Ciamician proposed a structure for the obtained photoisomeric product without a study devoted to confirming it. Some year later, Sernagiotto proposed, on the basis of some incomplete experimental results, a new structure for the photoisomer. Büchi proposed, on the basis of other experimental but not conclusive results, to return to the structure proposed by Ciamician. Finally, NMR spectrum of the photoisomer, performed in 1965, confirmed the Ciamician structure.
Keywords: Ciamician; Sernagiotto; Büchi; carvone; fotochimica; stereoselettività
Giacomo Ciamician (Figura 1) ha svolto un ruolo sicuramente molto significativo nello sviluppo della chimica organica a cavallo fra la fine dell’Ottocento e l’inizio del Novecento dello scorso millennio. Sicuramente ha svolto un ruolo importantissimo nello sviluppo delle applicazioni della fotochimica quando questa viene utilizzata per scoprire il comportamento di composti organici [1].

Figura 1. Giacomo Ciamician
Ciamician è un innovatore, aperto al nuovo, ma talvolta ha avuto anche atteggiamenti di chiusura difficilmente comprensibili. Sulla struttura tetraedrica del carbonio proposta da van’t Hoff ebbe a dire: «Io non voglio qui esaminare ulteriormente se questa concezione (…) debba essere considerata come durevole o come una forma di transizione. La storia della chimica organica sembra parlare assai in favore di quest’ultima possibilità» [2].
Ironia della sorte, il nome di Ciamician è legato alla prima reazione fotochimica caratterizzata da un’alta stereoselettività, dovuta alla presenza sul substrato di un atomo di carbonio tetraedrico chirale. La presenza di un atomo di carbonio chirale, infatti, essendo la reazione intramolecolare, porta alla formazione di nuovi legami che si possono formare solo su una delle facce della molecola, in maniera quindi stereoselettiva.
In un articolo del 1908 Ciamician descrive il comportamento del carvone, un terpene (Figura 2), quando questo viene irradiato in soluzione idroalcolica con luce solare in estate-autunno [3]. Questo composto ha un atomo di carbonio asimmetrico (quello indicato con l’asterisco), recando quattro sostituenti diversi.
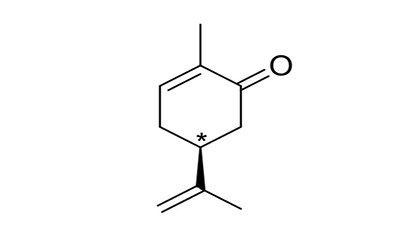
Figura 2. Il carvone
L’irradiazione nelle condizioni descritte porta alla formazione di una miscela di prodotti. Il più rilevante è una resina, derivante probabilmente dalla polimerizzazione del substrato. Rimane poi un residuo oleoso costituito dal carvone che non ha reagito e da una sostanza solida diversa. Per distillazione in corrente di vapore, si separa questo composto derivante dalla reazione fotochimica. Il composto è solido e fonde a 100 °C. La resa con cui Ciamician ottiene questo prodotto è molto bassa (6%), ma questo non gli impedisce di studiarlo.
Il prodotto della reazione risulta essere un composto carbonilico dato che reagisce con l’idrossilammina per dare la corrispondente ossima
R2C=O + NH2OH → R2C=NOH + H2O
e con la semicarbazide per dare il corrispondente semicarbazone
R2C=O + NH2NHCONH2 → R2C=NNHCONH2 + H2O
L’analisi elementare di questi derivati era in accordo con una formula bruta C10H14O, cioè con un isomero del substrato.
Sulla base di questi dati, considerando che la struttura del carvone non è planare (Figura 3), era possibile ipotizzare l’interazione fra i carboni appartenenti ai due doppi legami in modo da formare un ciclo a quattro termini.
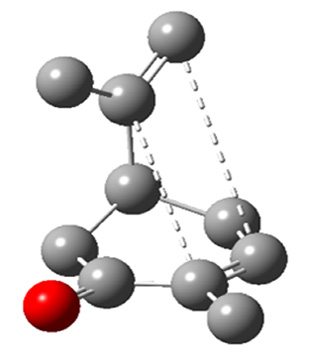
Figura 3. Possibile interazione fra gli atomi di carbonio olefinici del carvone
Il risultato è l’assegnazione della struttura 2 al prodotto della reazione (Schema 1). L’assegnazione non si basa su una vera e propria dimostrazione della struttura. È più il frutto di un ragionamento logico (l’analogia del comportamento osservato con la dimerizzazione degli acidi cinnamici) che un’assegnazione fatta con gli usuali all’epoca criteri di demolizione della struttura.
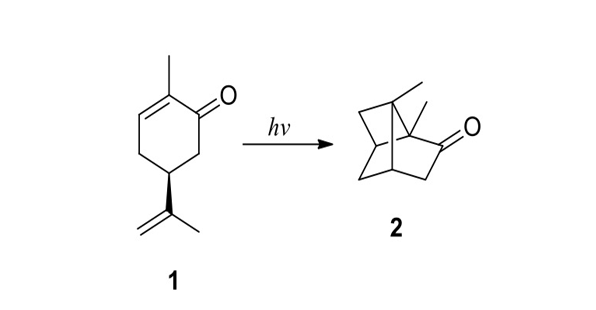
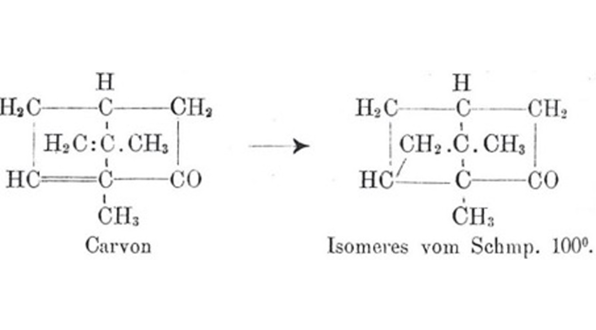
Schema 1. Isomerizzazione fotochimica del carvone; in basso la rappresentazione della reazione nell’articolo di Ciamician [3b].
Qualche anno dopo il lavoro viene ripreso da Emilio Sernagiotto (Figura 4) [4]. Questo ricercatore, dal 1913 a Bologna, pubblica due articoli sulla stessa reazione [5, 6]. Sernagiotto rifà la reazione e trova una resa nel prodotto di isomerizzazione del 12.3%.

Figura 4. Emilio Sernagiotto
Rispetto al lavoro originario di Ciamician, Sernagiotto effettua una serie di prove volte a identificare la struttura. Il composto non assorbe idrogeno in presenza di palladio su carbone, quindi non presenta doppi legami, è un composto saturo. Viene ossidato con permanganato in ambiente basico a caldo per dare due prodotti: il primo è un acido bicarbossilico. Questo risultato è in accordo con una struttura analoga a quella della canfora dove il gruppo carbonilico e il carbonio adiacente sono stati ossidati ad acido carbossilico (Figura 5a, struttura 3). Il secondo è un chetoacido che deriva dal primo per ulteriore ossidazione e decarbossilazione (l’analisi elementare mostra la presenza di un atomo di carbonio in meno) (Figura 5a, struttura 4). Questi risultati sono in accordo con la presenza di una sequenza del tipo indicata nella figura 5b.

Figura 5. Ossidazione con permanganato del prodotto di isomerizzazione
Il prodotto della reazione fotochimica viene poi trattato con acido solforico in soluzione alcolica, nelle condizioni in cui, secondo l’autore, si “compie (…) l’apertura dei nuclei secodarii nei chetoni policiclici e determina in questi la formazione di doppii legami”. Si ottiene un composto ancora isomero del carvone, che mantiene la funzione chetonica e ha un doppio legame (che viene ridotto per reazione con idrogeno).
Le caratteristiche fisiche del composto non ne permettono l’identificazione. Il trattamento del composto con permanganato porta alla formazione di acido levulinico CH3COCH2CH2CO2H.
La riduzione con sodio della funzione chetonica permette di ottenere il corrispondente alcol. Se il prodotto della reazione fotochimica viene trattato con pentacloruro di fosforo, si ottiene 2-clorocimolo 5 (Figura 6a). Questo prodotto indica che il gruppo isopropile presente nel carvone si mantiene nel prodotto di reazione così come la sua posizione relativa, permettendo di aggiungere un tassello alla struttura (Figura 6b).

Figura 6. Reazione del prodotto della reazione fotochimica con pentacloruro di fosforo
Questi sono i dati ottenuti sperimentalmente. Quali conclusioni Sernagiotto deriva da questi risultati? In primo luogo, l’autore dell’articolo considera che oltre al prodotto di reazione 2, rivendicato da Ciamician, era possibile anche la formazione di un altro prodotto (6), derivante dall’accoppiamento dei due doppi legami in ordine inverso (Schema 2).

Schema 2. I due possibili prodotti della reazione di isomerizzazione
Sernagiotto non è riuscito a identificare il prodotto di isomerizzazione in ambiente acido derivante da 2 o da 6, tuttavia ipotizza che nei due casi debba rompersi il legame indicato in rosso nello Schema 2. Questa assunzione, però, è del tutto arbitraria.
Dato che per ossidazione di questo ultimo prodotto di isomerizzazione Sernagiotto ottiene l’acido levulinico, conclude che il prodotto di isomerizzazione di 6, che identifica in maniera del tutto arbitraria nel composto 7 (Figura 7), è meglio in grado di dare per ossidazione la sequenza di cinque atomi di carbonio dell’acido levulinico.
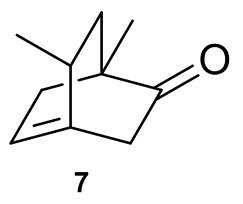
Figura 7. Ipotetico prodotto di isomerizzazione derivante da 6
In conclusione, per Sernagiotto il prodotto della reazione fotochimica è 6, e non 2, come asserito da Ciamician. Come abbiamo cercato di chiarire, però, queste asserzioni non si basano su indicazioni sperimentali certe, ma su ipotesi (la rottura di un certo legame invece di un altro) non dimostrate.
La reazione fotochimica del carvone viene poi ripresa da Büchi nel 1957 [7]. Büchi rifà la reazione e ottiene il prodotto di isomerizzazione con una resa del 9.4%.
Si accorge, però, anche che la reazione è stereospecifica. Partendo da un composto chirale [αD 55,6 (c 3,07 in etanolo)1], trova che il prodotto in cui vengono generati altri atomi di carbonio asimmetrico, mantiene un’attività ottica [αD 86,9 (c 1,02 in etanolo)]. Prova anche a identificare il prodotto della successiva isomerizzazione in ambiente acido descritta da Sernagiotto e, sulla scorta del solo spettro infrarosso che farebbe pensare alla presenza di metilene esociclico, assegna, anche in questo caso in maniera decisamente arbitraria, la struttura 8 al prodotto di isomerizzazione, prodotto questo che potrebbe formarsi a partire da 2 (Schema 3).

Schema 3. La reazione di isomerizzazione del prodotto della reazione fotochimica del carvone secondo Büchi [7]
La struttura del composto 8 non viene dimostrata. Il resto dell’articolo è inerente all’ossidazione con acido perbenzoico del prodotto della reazione fotochimica. Questa reazione fornisce due prodotti: quello principale viene descritto ma la struttura non viene dimostrata in alcun modo, quello secondario, che sembra derivare da un non comune processo di isomerizzazione, viene riconosciuto per demolizione fino all’ottenimento di un prodotto riconoscibile.
Infine, uno dei prodotti derivanti dall’ossidazione con acido perbenzoico, viene trattato con acido solforico per dare un composto aromatico. A me rimane piuttosto poco chiaro come si possa asseverare una struttura triciclica partendo da un prodotto di demolizione aromatico.
In conclusione, questa pubblicazione, come quelle precedenti sull’argomento, non è in grado di dimostrare in maniera conclusiva la struttura del prodotto di isomerizzazione fotochimica. Bisogna attendere il 1965 per mettere la parola fine a questa vicenda [8]. In primo luogo, viene rifatta la reazione, e, operando a concentrazioni di substrato più basse, si arriva al 46% di resa. La struttura 2 del prodotto della reazione fotochimica viene poi confermata dallo spettro NMR protonico.
Una lunga storia, quindi, che si protrae per circa sessanta anni, ma che ha permesso di capire cosa accadesse nella prima reazione fotochimica stereoselettiva descritta nella storia della chimica.
[1] M. D’Auria, Nascita della fotochimica in Italia, Aracne Editrice, Roma, 2017, pp. 49-78.
[2] G. Ciamcian, Problemi della chimica organica, Rivista di Scienza, 1907, 1, 46.
[3] a) G. Ciamician, P. Silber, Azioni chimiche della luce. Nota XII. Atti della Regia Accademia dei Lincei, Rendiconti, 1908, 17(I), 576-582; b) G. Ciamician, P. Silber, Chemische Lichtwirkungen. XIII. Berichte der deutschen chemischen Gesellschaft 1908, 41, 1928-1935.
[4] https://ilblogdellasci.wordpress.com/2023/10/12/emilio-sernagiotto-pioniere-della-microanalisi-organica-parte-1/; https://ilblogdellasci.wordpress.com/2023/10/15/emilio-sernagiotto-pioniere-della-microanalisi-organica-parte-2/.
[5] E. Sernagiotto, Sul prodotto di isomerizzazione del carvone alla luce. Carvoncanfora. Gazzetta Chimica Italiana, 1917, 47(I), 153-159.
[6] E. Sernagiotto, Sul prodotto di isomerizzazione del carvone alla luce. Carvoncanfora. Gazzetta Chimica Italiana, 1918, 48(I), 52-61.
[7] G. Büchi, I. M. Goldman, Photochemical reactions. VII. The intramolecular cyclization of carvone to carvoncanphor. Journal of American Chemical Society, 1957, 79, 4741-4748.
[8] J. Meinwald, R. A. Schneider, Photochemical synthesis and reaction of carvonecamphor. Journal of American Chemical Society, 1965, 87, 5218-5229.
1 aD viene chiamato potere rotatorio specifico. Indica la capacità che hanno gli enantiomeri di ruotare il piano di polarizzazione della luce polarizzata linearmente. Viene misurato l’angolo di rotazione. Per convenzione come sorgente di luce si utilizza l’emissione della riga D del Sodio a 598 nm; c indica la concentrazione in g/100 ml.